 138-7150-3845
138-7150-3845




图1 火焰原子吸收光谱仪 图2 石墨炉原子吸收光谱仪
一、原子吸收光谱分析定义
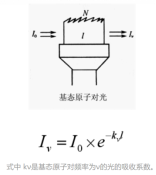
原子吸收光谱法(AAS),又称原子吸收分光光度法,基于物质所产生的原子蒸气对特征谱线的吸收,来进行定量分析的一种方法。分析过程:用(锐线光源)同种原子发射的特征辐射照射试样溶液被雾化和原子化的原子蒸气层,测量(特征辐射)透过的光强或吸光度,根据吸光度对浓度的关系计算试样中被测元素的含量。
二、原子吸收光谱的原理与特点
2.1原理
不同元素其Eq(激发态)、Ep(较低的激发态)和E0(基态)值不相同,一般元素的原子只能发射由其Eq、Ep或E0决定的特定波长或频率的光,即:f=Eq-Ep(或E0)/h。
每种物质的原子都具有特定的原子结构和外层电子排列,因此不同的原子被激发后,其电子具有不同的跃迁,能辐射出不同波长的光,即每种元素都有其特征的光谱线。在一定条件下,一种原子的电子可能在多种能态间跃迁而辐射不同特征波长的光,这些光是一组按次序排列的不同波长的线状光谱,这些谱线可作鉴别元素的依据。对元素作定性分析,谱线的强度与元素含量成正比,以此可测定元素的含量作定量分析。
2.2共振线和吸收线
共振激发:某种元素被激发后,核外电子从基态激发到最接近基态的最低激发态(E1)的过程。
共振发射线:电子从激发态(Eq)跃迁到基态(E0)所产生的发射谱线。
共振吸收线:电子从基态(E0)跃迁到激发态(Eq)所产生的吸收谱线。
2.3吸收定律
透过光的强度与原子蒸汽的厚度的关系,服从朗伯定律。
2.4 谱线轮廓变宽的原因
谱线轮廓:原子群从基态跃迁至激发态所吸收的谱线(吸收线)并不是绝对单色的几何线,而是具有一定的宽度。
Kν:光源辐射频率的函数,因此透射光的强度Iν随光的频率而变化。
V0:峰值吸收频率(或中心频率)
K0:最大吸收系数(或峰值吸收系数)
谱线的半宽度:在峰值吸收一半时(1/2K0),吸收线对应的频率范围
表征吸收线轮廓特征的值:中心频率和半宽度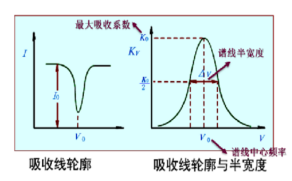
三、原子吸收的测量
3.1积分吸收
原子吸收的全部能量应是吸收线下面所包括的面积。原子蒸汽所吸收的全部能量称为积分吸收。
积分公式:
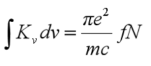
f——振子强度
e——电子电荷
N——单位积内的自由原子数
m——电子的质量
3.2峰值吸收
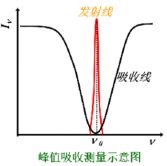
1955年Walsh提出采用锐线光源,测量谱线峰值吸收的办法。
锐线光源:能发射出谱线的半宽度很窄的发射线光源。
这种锐线光源使发射线的半宽度比吸收线的半宽度小得多,且发射线中心频率与吸收线中心频率一致。
3.3积分吸收与峰值吸收的关系
1955年澳大利亚学者沃尔森(Walsh)提出,在温度不太高的稳定火焰条件下,峰值吸收系数与火焰中被测元素的原子浓度也正比。
积分吸收与火焰中基态原子数的关系为:
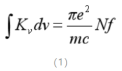
当仅考虑原子的热运动时,吸收系数的关系为:
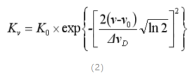
把式(2)积分后,得到:
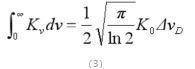
合并式(1)与式(3)整理后得到:
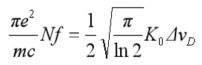
整理后,得到:
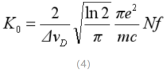
由式(4)可以得出峰值吸收系数K0与自由原子数N成正比。
3.4实际测量方法
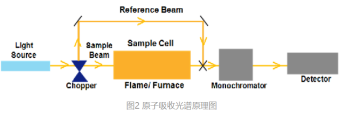
以一定光强的单色光I0通过原子蒸汽,然后测出被吸收的后的光强I,此吸收符合朗伯定律(图1)。
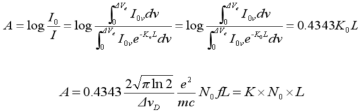
此式表明,当使用很窄的锐线光源作为原子吸收测量时,在一定条件下,测得的吸光度与原子蒸汽中待测元素的基态原子数成线性关系。
四、原子吸收光谱仪的构成、分类及特点
4.1组成
光源系统:空心阴极灯
原子化系统:火焰原子化器或石墨炉原子化器
分光系统:单色器
检测系统:光电倍增管等
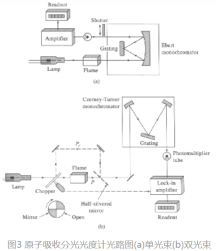
4.2原子分光光度的类型
单光束:结构简单、操作方便、价格低;易漂移(零漂)、稳定性差。
双光束:零漂移小、稳定性好。
4.2.1 光源(空心阴极灯)
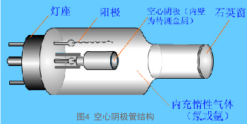
空心阴极:钨棒作为圆筒形筒内熔入被测元素
阳极:钨棒装有钛、锆、钽金属做成的阳极
管内充气:低压惰性气体Ne或Ar
工作电压:150~300伏
启动电压:300~500伏,稳流电源供电
锐线光产生原理:在高压电场下,阴极电子向阳极高速飞溅放电,并与载气原子碰撞,使之电离放出二次电子,而使场内正离子和电子增加以维持电流。
载气阳离子在电场中大大加速,轰击阴极表面时可将被测元素的原子从晶格中轰出来,即溅射。溅射出的原子大量聚集在空心阴极灯内,经与其它粒子碰撞而被激发,发射出相应元素的特征谱线——共振谱线。
4.2.2 原子化器
原子化器的作用:原子化实际上是破坏物质组成之间的化学键合,使各元素形成自由原子。原子化器的作用就是使试样中的待测元素转变成基态的气态原子。
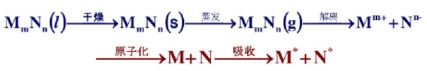
1.火焰原子化器
(1)火焰原子化过程
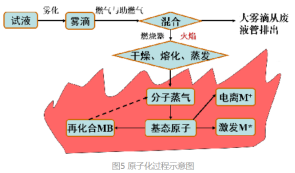
火焰原子化法:利用气体燃烧形成的火焰进行原子化,相当于一个喷雾燃烧器,三部分组成:
喷雾器:将试样溶液转为雾状
雾化室:内装撞击球和扰流器(去除大雾滴并使气溶胶均匀)
燃烧器:产生火焰并使试样蒸发和原子化
(2)火焰的基本特性:
A)作用:使待测物质分解形成基态原子
B)火焰类型:按燃气和助燃气的比例不同,分为中性、富燃和贫燃火焰
中性火焰:燃助比与化学计量关系接近(1:4)。火焰层次清晰、温度高、稳定、干扰少。
富燃火焰:还原性火焰,燃烧不完全,温度略低于中性火焰,其燃助比大于化学计量比(>1:3),适用于易形成难解离氧化物的元素测定,如Mo、Cr和稀土金属。干扰较多、背景高。
贫燃火焰:氧化性火焰,其燃助比小于化学计量比(<1:6),氧化性强、火焰温度较低、适用于易解离、易电离的元素,如碱金属、碱土金属的测定。
优点:
A)空气-乙炔火焰(2300℃):30多种金属元素的测定
B)笑气-乙炔火焰(3000℃):70多种金属元素的测定
缺点:
A)同轴气动雾化器的雾化效率低,5~10%;
B)火焰的原子化效率低、还伴随着复杂的火焰反应;
C)原子蒸气在光程中滞留时间短,10-4s;
D)大量气体的稀释作用,限制了检测线的降低;
E)只能测液体样品。
(3)火焰法可测元素(70余种)
Li、Na、Rb、Cs、Be、Mg、Ca、Sr、Ba、Sc、La、Y、Ti、Zr、Hf、V、Nb、Ta、Cr、Mo、W、Mn、Tc、Re、Fe、Ru、Os、Co、Rh、lr、Ni、Pd、Pt、Cu、Ag、Au、Zn、Cd、Hg、B、Al、Ga、In、Tl、Si、Ge、Sn、Pb、P、As、Sb、Bi、Se、Te、Ce、Th、Pr、Nd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu、U等。
2.石墨炉原子化器
(1)原理
利用高达数百安培的电流,通过电阻值很高的石墨管产生高温(3000℃)以实现样品的蒸发和原子化。
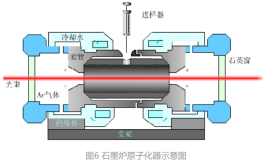
(2)原子化过程
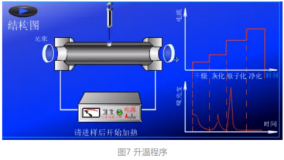
样品通常以液体形式导入石墨管中,在惰性气氛中分几个升温程序进行加热使其原子化。
升温程序为干燥、灰化、原子化和高温净化四步。
干燥:去除溶剂,防止样品溅射
灰化:使基体和有机物尽量挥发出去
原子化:待测化合物分解为基态原子,此时停止通Ar气,延长原子停留时间,提高灵敏度
净化:样品测定完成,高温去残渣,净化石墨管
优点:
A)具有较高的可控温度,3400℃;
B)原子蒸汽在光程中的滞留时间长,10-1~10-2 s;
C)样品消耗量少(μg和μL级);
D)抗干扰能力强——灰化分离;
E)灵敏度高,比火焰提高2~3数量级。
缺点:
A)精密度、重现性差;
B)存在记忆效应;
C)杂散光引起的背景干扰较严重,需要校正。
(3)石墨炉法可测元素(60余种)
Li、Na、K、Rb、Cs、Be、Mg、Ca、Sr、Ba、Sc、Y、La、Ti、V、Cr、Mo、Mn、Tc、Re、Fe、Ru、Os、Co、Rh、lr、Ni、Pd、Pt、Cu、Ag、Au、Zn、Cd、Hg、B、Al、Ga、In、Tl、Si等
3.<span style="font-family: